Calor específico
El calor específico es la cantidad de calor que se necesita por unidad de masa para elevar la temperatura un grado Celsio. La relación entre calor y cambio de temperatura, se expresa normalmente en la forma que se muestra abajo, donde c es el calor específico. Esta fórmula no se aplica si se produce un cambio de fase, porque el calor añadido o sustraido durante el cambio de fase no cambia la temperatura.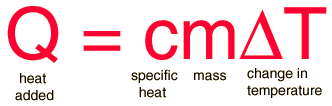
El calor específico del agua es 1 caloría/gramo °C = 4,186 julios/gramo °C que es mas alto que el de cualquier otra sustancia común. Por ello, el agua desempeña un papel muy importante en la regulación de la temperatura. El calor específico por gramo de agua es mucho mas alto que el de un metal, como se describe en elejemplo agua-metal. En la mayoría de los casos es mas significativo comparar los calores específicos molares de las sustancias.
De acuerdo con la ley de Dulong y Petit, el calor específico molar de la mayor parte de los sólidos, a temperatura ambiente y por encima, es casi constante. A mas baja temperatura, los calores específicos caen a medida que los procesos cuánticos se hacen significativos. El comportamiento a baja temperatura se describe por el modelo Einstein-Debye para el calor específico.
Concepto de calor
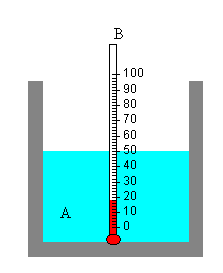 | Cuando dos cuerpos A y B que tienen diferentes temperaturas se ponen en contacto térmico, después de un cierto tiempo, alcanzan la condición de equilibrio en la que ambos cuerpos están a la misma temperatura. Un fenómeno físico análogo son los vasos comunicantes.Supongamos que la temperatura del cuerpo A es mayor que la del cuerpo B, TA>TB. Observaremos que la temperatura de B se eleva hasta que se hace casi igual a la de A. En el proceso inverso, si el objeto B tiene una temperatura TB>TA, el baño A eleva un poco su temperatura hasta que ambas se igualan. |
Decimos que una cantidad de calor DQ se transfiere desde el sistema de mayor temperatura al sistema de menor temperatura.
- La cantidad de calor transferida es proporcional al cambio de temperatura DT.
- La constante de proporcionalidad C se denomina capacidad calorífica del sistema.
Si los cuerpos A y B son los dos componentes de un sistema aislado, el cuerpo que está a mayor temperatura transfiere calor al cuerpo que está a menos temperatura hasta que ambas se igualan
Si TA>TB
- El cuerpo A cede calor: DQA=CA·(T-TA), entonces DQA<0
- El cuerpo B recibe calor: DQB=CB·(T-TB), entonces DQB>0
La temperatura de equilibrio, se obtiene mediante la media ponderada
La capacidad calorífica de la unidad de masa se denomina calor específico c. C=mc
La fórmula para la transferencia de calor entre los cuerpos se expresa en términos de la masa m, del calor específico c y del cambio de temperatura.
DQ=m·c·(Tf-Ti)
donde Tf es la temperatura final y Ti es la temperatura inicial.
El calor específico es la cantidad de calor que hay que suministrar a un gramo de una sustancia para que eleve en un grado centígrado su temperatura.
Joule demostró la equivalencia entre calor y trabajo 1cal=4.186 J. Por razones históricas la unidad de calor no es la misma que la de trabajo, el calor se suele expresar en calorías.
El calor específico del agua es c=1 cal/(g ºC). Hay que suministrar una caloría para que un gramo de agua eleve su temperatura en un grado centígrado.
Fundamentos físicos
Cuando varios cuerpos a diferentes temperaturas se encuentran en un recinto adiabático se producen intercambios caloríficos entre ellos alcanzándose la temperatura de equilibrio al cabo de cierto tiempo. Cuando se ha alcanzado este equilibrio se debe cumplir que la suma de las cantidades de calor intercambiadas es cero.Se define calor específico c como la cantidad de calor que hay que proporcionar a un gramo de sustancia para que eleve su temperatura en un grado centígrado. En el caso particular del agua c vale 1 cal/(g ºC) ó 4186 J(kg ºK).
La unidad de calor específico que más se usa es cal/(g ºC) sin embargo, debemos de ir acostumbrándonos a usar el Sistema Internacional de Unidades de Medida, y expresar el calor específico en J/(kg·K). El factor de conversión es 4186.
| Sustancia | Calor específico (J/kg·K) |
| Acero | 460 |
| Aluminio | 880 |
| Cobre | 390 |
| Estaño | 230 |
| Hierro | 450 |
| Mercurio | 138 |
| Oro | 130 |
| Plata | 235 |
| Plomo | 130 |
| Sodio | 1300 |
La cantidad de calor recibido o cedido por un cuerpo se calcula mediante la siguiente fórmula
Q=m·c·(Tf-Ti)
Donde m es la masa, c es el calor específico, Ti es la temperatura inicial y Tf la temperatura final
- Si Ti>Tf el cuerpo cede calor Q<0
- Si Ti<Tf el cuerpo recibe calor Q>0
Supongamos que el calorímetro está a la temperatura inicial T0, y sea
- mv es la masa del vaso del calorímetro y cv su calor específico.
- mt la masa de la parte sumergida del termómetro y ct su calor específico
- ma la masa de la parte sumergida del agitador y ca su calor específico
- M la masa de agua que contiene el vaso, su calor específico es la unidad
Sean m y c las masa y el calor específico del cuerpo problema a la temperatura inicial T.
En el equilibrio a la temperatura Te se tendrá la siguiente relación.
(M+mv·cv+mt·ct+ma·ca)(Te-T0)+m·c(Te-T)=0
La capacidad calorífica del calorímetro es
k=mv·cv+mt·ct+ma·ca
se le denomina equivalente en agua del calorímetro, y se expresa en gramos de agua.
Por tanto, representa la cantidad de agua que tiene la misma capacidad calorífica que el vaso del calorímetro, parte sumergida del agitador y del termómetro y es una constante para cada calorímetro.
El calor específico desconocido del será por tanto
En esta fórmula tenemos una cantidad desconocida k, que debemos determinar experimentalmente.
Determinación del equivalente en agua del calorímetro
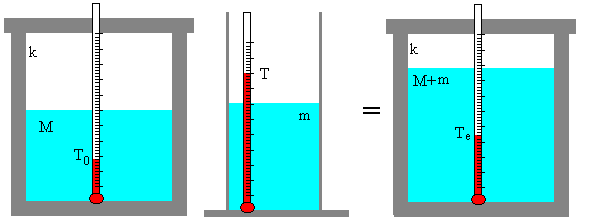
Se ponen M gramos de agua en el calorímetro, se agita, y después de un poco de tiempo, se mide su temperatura T0. A continuación, se vierten m gramos de agua a la temperatura T. Se agita la mezcla y después de un poco de tiempo, se mide la temperatura de equilibrio Te.
Como el calorímetro es un sistema adibáticamente aislado tendremos que
(M+k)(Te-T0)+m(Te-T)=0
http://www.youtube.com/watch?v=J5fst-9I7n8
Calor latente de fusión
- El hielo flota en el agua, la densidad del hielo es menor que la densidad del agua. Este hecho, nos permite diseñar un experimento de medida del calor de fusión del agua.
- El segundo experimento, es el procedimiento de las mezclas, similar al empleado para determinar el calor específico de un sólido
Cambios de estado
Normalmente, una sustancia experimenta un cambio de temperatura cuando absorbe o cede calor al ambiente que le rodea. Sin embargo, cuando una sustancia cambia de fase absorbe o cede calor sin que se produzca un cambio de su temperatura. El calor Q que es necesario aportar para que una masa m de cierta sustancia cambie de fase es igual a
Q=mL
donde L se denomina calor latente de la sustancia y depende del tipo de cambio de fase.
Por ejemplo, para que el agua cambie de sólido (hielo) a líquido, a 0ºC se necesitan 334·103 J/kg. Para que cambie de líquido a vapor a 100 ºC se precisan 2260·103 J/kg.
En la siguiente tabla, se proporcionan los datos referentes a los cambios de estado de algunas sustancias.
| Sustancia | T fusión ºC | Lf ·103 (J/kg) | T ebullición ºC | Lv ·103 (J/kg) |
| Hielo (agua) | 0 | 334 | 100 | 2260 |
| Alcohol etílico | -114 | 105 | 78.3 | 846 |
| Acetona | -94.3 | 96 | 56.2 | 524 |
| Benceno | 5.5 | 127 | 80.2 | 396 |
| Aluminio | 658.7 | 322-394 | 2300 | 9220 |
| Estaño | 231.9 | 59 | 2270 | 3020 |
| Hierro | 1530 | 293 | 3050 | 6300 |
| Cobre | 1083 | 214 | 2360 | 5410 |
| Mercurio | -38.9 | 11.73 | 356.7 | 285 |
| Plomo | 327.3 | 22.5 | 1750 | 880 |
| Potasio | 64 | 60.8 | 760 | 2080 |
| Sodio | 98 | 113 | 883 | 4220 |
Fuente: Koshkin N. I., Shirkévich M. G.. Manual de Física elemental, Edt. Mir (1975) págs. 74-75.
Los cambios de estado se pueden explicar de forma cualitativa del siguiente modo:
En un sólido los átomos y moléculas ocupan las posiciones fijas de los nudos de una red cristalina. Un sólido tiene en ausencia de fuerzas externas un volumen fijo y una forma determinada.
Los átomos y moléculas vibran, alrededor de sus posiciones de equilibrio estable, cada vez con mayor amplitud a medida que se incrementa la temperatura. Llega un momento en el que vencen a las fuerzas de atracción que mantienen a los átomos en sus posiciones fijas y el sólido se convierte en líquido. Los átomos y moléculas siguen unidos por las fuerzas de atracción, pero pueden moverse unos respecto de los otros, lo que hace que los líquidos se adapten al recipiente que los contiene pero mantengan un volumen constante.
Cuando se incrementa aún más la temperatura, se vencen las fuerzas de atracción que mantienen unidos a los átomos y moléculas en el líquido. Las moléculas están alejadas unas de las otras, se pueden mover por todo el recipiente que las contiene y solamente interaccionan cuando están muy próximas entre sí, en el momento en el que chocan. Un gas adopta la forma del recipiente que lo contiene y tiende a ocupar todo el volumen disponible.
Un ejemplo clásico en el que se utilizan los conceptos de calor específico y calor latente es el siguiente:
Determinar el calor que hay que suministrar para convertir 1g de hielo a -20 ºC en vapor a 100ºC. Los datos son los siguientes:
- Calor específico del hielo ch=2090 J/(kg K)
- Calor de fusión del hielo Lf=334·103 J/kg
- Calor específico del agua c=4180 J/(kg K)
- Calor de vaporización del agua Lv=2260·103 J/kg
Etapas:
- Se eleva la temperatura de 1g de hielo de -20ºC (253 K) a 0ºC (273 K)
Q1=0.001·2090·(373-253)=41.8 J
- Se funde el hielo
Q2=0.001·334·103=334 J
- Se eleva la temperatura del agua de 0º C (273 K) a 100 ºC (373 K)
Q3=0.001·4180·(373-273)=418 J
- Se convierte 1 g de agua a 100ºC en vapor a la misma temperatura
Q4=0.001·2260·103=2260 J
El calor total Q=Q1+Q2+Q3+Q4=3053.8 J.
Si disponemos de una fuente de calor que suministra una energía a razón constante de q J/s podemos calcular la duración de cada una de las etapas
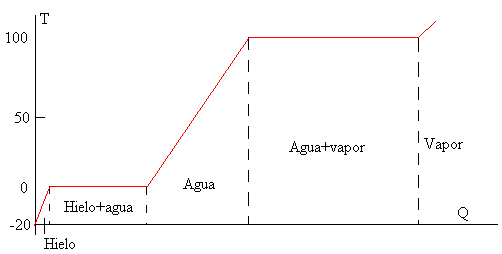
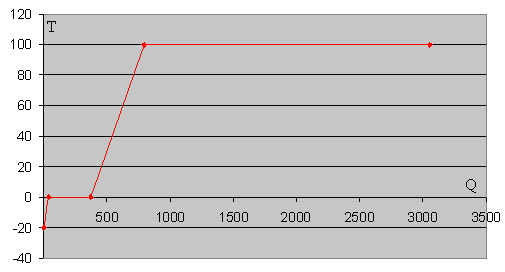
En la figura, que no se ha hecho a escala, se muestra cómo se va incrementando la temperatura a medida que se aporta calor al sistema. La vaporización del agua requiere de gran cantidad de calor como podemos observar en la gráfica y en los cálculos realizados en el ejemplo.
La figura de abajo, está hecha a escala con el programa Excel de Microsoft, tomando los datos de la tabla
| Calor, Q | Temperatura, T |
| 0 | -20 |
| 41.8 | 0 |
| 375.8 | 0 |
| 793.8 | 100 |
| 3053.8 | 100 |
Medida del calor latente de fusión
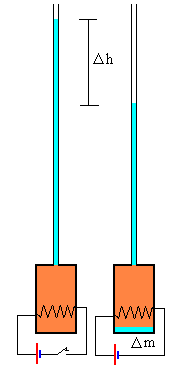
Se llena un termo con hielo y se cierra. A través del tapón se pasa un largo tubo de vidrio de pequeña sección S y dos cables que conectan con una resistencia por la que circula una corriente eléctrica que calienta el hielo para convertirlo en agua a 0ºC.
Se añade agua a través del tubo para rellenar la botella y propio el tubo.
En la parte izquierda de la figura, se muestra la situación inicial. En la parte derecha, la situación al cabo de un cierto tiempo t después de conectar la resistencia a una batería.
La resistencia eléctrica calienta el hielo, se funde y el volumen del sistema disminuye, como consecuencia, pasa agua del tubo de vidrio al termo. Medimos la variación de altura del agua en el tubo vertical graduado.
El experimento consiste en medir la energía necesaria para reducir el volumen del sistema en una determinada cantidad a temperatura constante y a presión constante.
En el estado inicial tenemos una masa M de hielo de densidad ρh=0.917 g/cm3 en un volumen V0.
M= ρh·V0
Al cabo de un cierto tiempo t, una masa Δm de hielo se ha convertido en agua de densidad ρa=1.0 g/cm3, El volumen Vdel sistema disminuye
La variación de volumen, en valor absoluto, es
Para fundir una masa Δm de hielo y convertirla en agua se necesita una cantidad de calor
Q=Lf·Δm
donde Lf es el calor latente de fusión
Al disminuir el volumen del sistema, el agua del tubo vertical entra en el termo, disminuyendo la altura en ΔV=SΔh
Podemos medir el calor Q que suministra la resistencia eléctrica en el tiempo t.
Q=i2·R·t
Medimos la variación de la altura Δh de agua en el tubo de vidrio vertical y despejamos el calor latente de fusión Lf
Ejemplo:
- La sección del tubo vertical vale S=0.1782 cm2
- La densidad del hielo ρh=0.917 g/cm3
- La densidad del agua ρa=1.0 g/cm3
Se precisan Q=13140 J para que el nivel de agua en el tubo vertical disminuya Δh=20 cm
http://www.youtube.com/watch?v=KzfufTkcuDk
Leyes de los Gases
La determinación de una ecuación de estado de los gases implica inevitablemente la medición de la presión, o fuerza por unidad de área, que un gas ejerce sobre las paredes del recipiente que lo contiene. La presión de los gases comúnmente se expresa en atmósferas o milímetros de mercurio.
El estudio sistemático del comportamiento de los gases le interesó a los científicos durantes siglos. Destacan los nombres de varios investigadores que establecieron las propiedades de los gases.
Ley De Boyle
La relación matemática que existe entre la presión y el volumen de un cantidad dad de un gas a una cierta temperatura fue descubierta porRobert Boyle en 1662. Boyle encerró una cantidad de aire en el extremo cerrado de un tubo en forma de U, utilizando mercurio como fluido de retención. Boyle descubrió que el producto de la presión por volumen de una cantidad fija de gas era un valor aproximadamente constante. Notó que si la presión de aire se duplica su volumen era la mitad del volumen anterior y si la presión se triplicaba el volumen bajaba a una tercera mitad del inicial. También observo que al calentar un gas aumentaba su volumen si la presión se mantenía constante, a este proceso se le llama proceso isoborico.
La ley de Boyle se puede expresar como:
donde Kn,t es una constante cuyo valor depende de la temperatura y de la cantidad de gas.
Hoy, después de numerosas confirmaciones del trabajo de Boyle y experimentos adicionales, la relación entre el volumen y la presión de un gas se conoce como Ley de Boyle. Si aumenta la presión de un gas. El volumen disminuye proporcionalmente; por lo tanto, si la presión disminuye, el volumen aumenta. Si dos cantidades sob inversamente proporcionales, cuando una aumenta la otra disminuye.
Ejemplo: piense en un globo inflado, cuando oprimimos el globo (aumenta la presión) el volumen disminuye; al soltarlo (disminuye la presión) el volumen aumenta.
Un método que se utiliza extensamente para demostrar la relación entre dos cantidades es la construcción de gráficas, en las que se aprecia fácilmente como varían 2 cantidades entre sí.
Ley de Boyle:
“El volumen de un gas, a temperatura constante, es inversamente proporcional a la presión”
Ley De Charles:
En 1787, Jacques Charles investigó la relación existente entre el volumen y la temperatura de una gas a presión constante. Usó un aparato similar al que se ve en la figura:
Al conservar la presión constante, el volumen aumenta y cuando la temperatura disminuye, el volumen también disminuye. Luego, había una proporcionalidad lineal directa entre el volumen y la temperatura, la cual se conoce como Ley de Charles.
Ejemplo: un globo lleno aumenta su volumen cuando se le caliente y lo disminuye cuando se le enfría.
Ley de Charles:
“El volumen de un gas a presión constante es directamente proporcional a la temperatura kelvin”.
Ley de las Presiones Parciales de Dalton:
Cuando Dalton formuló por primera vez su teoría atómica poco había elaborado la teoría acerca de la vaporización del agua y el comportamiento de mezclas gaseosas. A partir de sus mediciones dedujo que dos gases es una mezcla actuaban de manera mutuamente independiente.
Por ejemplo si se colocan tres gases en un recipiente de determinado volumen, V, se puede considerar que cada uno de los gases ocupa todo el volumen. Es decir, si el gas está cerrado, las moléculas del gas debido a su rápido movimiento azar y ase tamaño tan pequeño, ocuparán todo el recipiente. Luego, cada uno de los tres gases que forman todo el recipiente. Luego, cada uno de los tres gases forman la mezcla tendrá el volumen V. Ahora, si temperatura del recipiente tuviera un valor constante, T, cada uno de los gases tendría esta temperatura.
Si estudiamos cada uno de estos gases en forma separada, la contribución a la presión de cada componente está directamente relacionada con el número de moles del componente y con la razón a la que las partículas chocan con las paredes del recipiente. Dado que cada componente tiene el mismo volumen y temperatura, las diferencias entre las presiones que ejercen se deberá a los distintos números de moles.
La presión que ejerce un componente determinado de la mezcla de gases si éste ocupara por sí solo el recipiente, se llama presión parcial del componente. Las presiones parciales se calculan aplicando la ley de los gases ideales a cada componente. Así la presión parcial, Pc, para una componente consistente en nc moles está dada por la expresión:
Se puede calcular la presión parcial de cada componente, si se conoce el número de moles de cada uno en la mezcla encerrada en un volumen determinado, a una temperatura dada. Debido a que las partículas de cada gas componente se conducen en forma independiente, la presión total que ejerza la mezcla será un resultado de todas las partículas.
Establece que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Pt = pa + pb + pc + ...
Está relación se conoce como Ley de las Presiones Parciales de Dalton e indica que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los componentes de la mezcla.
La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla de gases.
Ley de Gay-Lussac
Cuando se investiga experimentalmente como depende entre sí el volumen y la temperatura de un gas a una presión fija, se encuentra que el volumen aumenta linealmente al aumentar la temperatura. Esta relación se conoce como Ley de Charles y Gay-Lussac, y se puede expresar algebraicamente por:
V = V0(1 + "t)
Donde V0 es el volumen que a la temperatura de 0 ºC, " es una constante que tiene aproximadamente el valor 1/273 para todos los gases y t es la temperatura en la escala Celsius. Esta ecuación establece que el volumen de un gas aumenta linealmente al aumentar su temperatura.
Biografías
Robert Boyle (1627-1691):
Científico británico, uno de los primeros defensores de los métodos científicos y uno de los fundadores de la química moderna.
Nació en Lismore, Irlanda, y estudió en Ginebra, Suiza. Se estableció en Inglaterra y se dedicó a la investigación científica. Boyle es considerado uno de los fundadores de los métodos científicos modernos porque creyó en la necesidad de la observación objetiva y de los experimentos verificables en los laboratorios, al realizar los estudios científicos.
Boyle fue el primer químico que aisló un gas. Perfeccionó la bomba de aire y sus estudios le condujeron a formular, independientemente de su colega francés Edme Mariotte, la ley de física conocida hoy como “ley de Boyle-Mariotte”. Esta ley establece que a una temperatura constante, la presión y el volumen de un gas son inversamente proporcionales. En el campo de la química, Boyle observó que el aire se consume en el proceso de combustión y que los metales ganan peso cuando se oxidan. Reconoció la diferencia entre un compuesto y una mezcla, y formuló su teoría atómica de la materia basándose en sus experimentos de laboratorio. En su obra El químico escéptico (1661), Boyle atacó la teoría propuesta por el filósofo y científico griego Aristóteles (384-322 a.C.) según la cual la materia está compuesta por cuatro elementos: tierra, aire, fuego y agua. Propuso que partículas diminutas de materia primaria se combinan de diversas maneras para formar lo que él llamó corpúsculos, y que todos los fenómenos observables son el resultado del movimiento y estructura de los corpúsculos. Boyle fue también el primero en verificar las diferencias entre ácidos, bases y sales. Entre sus obras están Origen de formas y características según la filosofía corpuscular(1666) y Discurso de las cosas más allá de la razón (1681). Boyle fue uno de los miembros fundadores de la Royal Society de Londres.
Joseph Louis Gay-Lussac (1778-1850):
Químico y físico francés conocido por sus estudios sobre las propiedades físicas de los gases. Nació en Saint Léonard y estudió en la École Polytecnique y en la École des Ponts et Chaussées de París. Después de impartir la enseñanza en diversos institutos fue, desde 1808 hasta 1832, profesor de física en la Sorbona.
En 1804 realizó una ascensión en globo para estudiar el magnetismo terrestre y observar la composición y temperatura del aire a diferentes altitudes. En 1809 formuló la ley de los gases que sigue asociada a su nombre.
La ley de Gay-Lussac de los volúmenes de combinación afirma que los volúmenes de los gases que intervienen en una reacción química (tanto de reactivos como de productos) están en la proporción de números enteros pequeños. En relación con estos estudios, investigó junto con el naturalista alemán Alexander von Humboldt, la composición del agua, descubriendo que se compone de dos partes de hidrógeno por una de oxígeno. Unos años antes, Gay-Lussac había formulado una ley, independientemente del físico francés Jacques Alexandre Charles, que afirmaba que el volumen de un gas es directamente proporcional a su temperatura absoluta si la presión se mantiene constante; hoy se conoce como ley de Charles y Gay-Lussac.
En 1809 Gay-Lussac trabajó en la preparación del potasio y el boro e investigó las propiedades del cloro y del ácido cianhídrico. En el campo de la industria química desarrolló mejoras en varios procesos de fabricación y ensayo. En 1831 fue elegido miembro de la Cámara de los Diputados y en 1839 del Senado.
Jacques Alexandre César Charles (1746-1823):
Químico, físico y aeronauta francés, nacido en Beaugency (Loiret). En 1783 construyó el primer globo de hidrógeno y ascendió a una altura de casi 3.000 m. En 1787 descubrió la relación entre el volumen de un gas y su temperatura, conocida como ley de Charles y Gay-Lussac. En 1785 ingresó en la Academia Francesa.
John Dalton (1766-1844):
Químico y físico británico, que desarrolló la teoría atómica en la que se basa la ciencia física moderna. Nació el 6 de septiembre de 1766, en Eaglesfield, Cumberland (hoy Cumbria). Fue educado en una escuela cuáquera de su ciudad natal, en donde comenzó a enseñar a la edad de 12 años. En 1781 se trasladó a Kendal, donde dirigió una escuela con su primo y su hermano mayor. Se fue a Manchester en 1793 y allí pasó el resto de su vida como profesor, primero en el New College y más tarde como tutor privado.
En 1787 Dalton comenzó una serie de estudios meteorológicos que continuó durante 57 años, acumulando unas 200.000 observaciones y medidas sobre el clima en el área de Manchester. El interés de Dalton por la meteorología le llevó a estudiar un gran número de fenómenos así como los instrumentos necesarios para medirlos. Fue el primero en probar la teoría de que la lluvia se produce por una disminución de la temperatura, y no por un cambio de presión atmosférica.
Sin embargo, a la primera obra de Dalton, Observaciones y ensayos meteorológicos (1793), se le prestó muy poca atención.
En 1794 presentó en la Sociedad Filosófica y Literaria de Manchester un ensayo sobre el daltonismo, un defecto que él mismo padecía; el ensayo fue la primera descripción de este fenómeno, denominado así por el propio Dalton.
Su contribución más importante a la ciencia fue su teoría de que la materia está compuesta por átomos de diferentes masas que se combinan en proporciones sencillas para formar compuestos. Esta teoría, que Dalton formuló por primera vez en 1803, es la piedra angular de la ciencia física moderna (véase Química; Física). En 1808 se publicó su obra Nuevo sistema de filosofía química, que incluía las masas atómicas de varios elementos conocidos en relación con la masa del hidrógeno. Sus masas no eran totalmente precisas pero constituyen la base de la clasificación periódica moderna de los elementos. Dalton llegó a su teoría atómica a través del estudio de las propiedades físicas del aire atmosférico y de otros gases. En el curso de la investigación descubrió la ley conocida como `ley de Dalton de las presiones parciales', según la cual, la presión ejercida por una mezcla de gases es igual a la suma de la presiones parciales que ejercería cada uno de los gases si él solo ocupara el volumen total de la mezcla.
Dalton fue elegido miembro de la Sociedad Real de Londres en 1822 y cuatro años más tarde se le concedió la medalla de oro de esta sociedad. En 1830 Dalton se convirtió en uno de los ocho socios extranjeros de la Academia de Ciencias Francesa. Murió el 27 de julio de 1844 en Manchester.
Ilustraciones
John Dalton:

Ley de Boyle:

Ley de Charles y Gay Lussac:

Ley de las Presiones Parciales de Dalton:
Conclusión
Bibliografía
Dickson T. R.; Introducción a la Química; Primera Edición, México; 1982; Publicaciones Culturales
